Кез келген дерлік ауруды емдеу тиімділігі сапалы дәрілік заттарды қолдануға байланысты. Сондықтан денсаулық сақтау жүйесінде осы мәселеге айрықша назар аударылады. Қазақстандықтар сапасыз немесе жалған препараттарға тап болмау үшін елімізде фармацевтикалық өнімдердің қолданыстағы айналымының барлық сатысында олардың қауіпсіздігі мен сапасын қамтамасыз етуге бағытталған реттеу механизмдерінің біртұтас жүйесі жұмыс істейді.
Бүкіл іс дәрілерді нарыққа шығарудың өзіндік алғышарты болып табылатын мемлекеттік тіркеуден басталады.
Қазақстанда елімізде өндірілетін, сондай-ақ оның аумағына шеттен әкелінетін дәрі-дәрмектің бәрі тіркеледі. Бұл ретте мемлекеттік тіркеу және тіркеуден кейінгі өнім сапасын бағалау – екі түрлі рәсім екенін түсініп алу маңызды.
"Тіркеу – бұл нарыққа шығару деген сөз. Егер біз дәрілік зат туралы айтсақ, тіркеу сатысында препараттың тиімділігі мен қауіпсіздігі, оны нарыққа шығарудың мақсатқа сай болуы, өндіріс технологиясын қадағалау мәселелері айқындалады. Сонымен қатар, біздің сарапшылар клиникаға дейінгі, клиникалық және зертханалық сынақтар қорытындыларын зерттейді. Нәтижесінде тіркеу кезінде нақты бір дәрінің сәйкес келуі тиіс болатын сапа, қауіпсіздік және тиімділік параметрлері бекітіледі. Өнім сапасын бағалау кезінде тіркеуден кейінгі шығарылатын дәрілердің әр сериясы тіркеу кезінде белгіленген талаптарға қаншалықты сәйкес келетіні айқындалады", – деп мәлімдеді ДЗСҰО Сапаны бағалау департаментінің басшысы Айсұлу Ахимова.

Тіркеуден кейінгі кезеңдегі дәрілік заттар мен медициналық бұйымдардың сапасын қамтамасыз ету жүйесі шеттен әкелінген немесе өзімізде өндірілген өнімнің әр сериясының сапасын бағалау, фармакологиялық қадағалау, қазақстандық нарық айналымында жүрген дәрілік заттардың үлгілерін қауіпке бағдарланған тәсілмен іріктеу және оларға зертханалық сынақ жүргізіп, сапасын растау, сондай-ақ фармацевтикалық қызметті инспекциялау мен бақылау жүргізу сияқты рәсімдерді қамтиды.
Сапаны бағалау рәсімі бірқатар елеулі өзгерістерге ұшырады. Заманауи жүйе фармацевтикалық өнім айналымы саласындағы субъектілердің жауапкершілігі мен адалдығының жоғары деңгейіне арқа сүйейді. Бүгінде Ұлттық орталықтың сарапшылары препарат үлгілеріне зертханалық сынақтар өткізбейді, тек өтінім берушілер ұсынған құжаттарға ғана сараптама жасайды.
Сапаны бағалау рәсімі не үшін қажет? Дүниежүзілік денсаулық сақтау ұйымының ұсынымдарына сәйкес, елдер заңнамасында әкелінетін және әкетілетін фармацевтикалық өнімнің шығу тегі, апарылатын жері, шекараны қалай кесіп өткені туралы ақпарат, сондай-ақ сапасы, қауіпсіздігі және тиімділігі туралы өндірушінің мәліметтерін тіркеу және зерттеу талаптары қарастырылуы тиіс. Осы орайда, заңнама әрбір әкелу және әкету рәсімі үшін рұқсат алуды талап етуі тиіс. Біздің елімізде тіркелген дәрілік заттарды әкелу мен әкетуді лицензиялау немесе рұқсат алу рәсімі жоқ.
Сондықтан тиісті лицензиясыз жеке тұлғалар елге әкелген, күмәнді елде өндірілген немесе фармацевтикалық өнім сапасы бойынша тиісті құжаттары болмаған әлде ресми кедендік органдар және т.б. арқылы өтпеген ("алып-сатарлық бизнес") жағдайлардағы өнімнің дәріханалар және медициналық ұйымдар айналымында болу қауіптері бар. Фармацевттер мен медициналық қызметкерлердің тауарды сатып алу кезінде тауардың шығу тегін сараптау, сертификат түпнұсқалығын анықтау немесе сертификаттың сапа жөніндегі нормативтік құжат талаптарына сәйкестігін тексеру немесе жүк-кеден декларациясына, GMP сертификатына және өзге талаптарға сай екеніне зерттеу жүргізілмейді. Көптеген жағдайларда мамандар Мемлекеттік тізілім деректерімен салыстырып тексеру ғана жүргізетінін шамалауға болады.
Атап өткендей, Ұлттық орталықта препарат үлгілеріне зертханалық зерттеу жүргізілмейді. Сарапшылар тек өндірушінің өнім сапасын растайтын құжаттарын ғана зерттейді, өйткені, бұл рәсім өндірушілерге деген сенімге негізделген.
"Өндірушілер бізге құжаттар пакетін ұсынады, олардың арасында өндірушінің дәрілік зат сапасын, өндіріс стандарттарының қадағалануын растайтын құжаттар болады. Біз өндіруші ел туралы құжаттарды, біздің елімізге дәрілік затты әкелудің заңдылығын айқындайтын кедендік құжаттарды зерттейміз. Өтінім берушінің үлкен көлемдегі дәрілік заттар айналымымен айналысу құқығы мен шарттарының бар-жоғы да есепке алынады. Бұл рәсім қорытындылары бойынша сәйкестік сертификаты беріледі, оның қолда болуы өнімнің белгіленген жолмен айналымға түскенін және өндіруші тарапынан осы өнім сериясының сапасы тұрғысынан оны тіркеу кезінде белгіленген талаптарға сәйкестігіне бақылау жасалғанын айғақтай алады", – деп атап өтті сарапшы.
Фармацевтикалық өнімнің әр сериясын декларациялаудан тыс, Ұлттық орталықтың сарапшылары қауіптері бар белгілі бір өнімді зертханалық сынақтан өткізумен нарықтан іріктеуді жүргізеді. Мысалы, бұл топқа парентеральді препараттар (қабылдау кезінде асқазан-ішек жолын айналып өтетін дәрілік заттар), айрықша сақтау шарттары бар, мысалы, жылуға төзімсіз препараттар жатады. Сонымен қатар, ТМККК және МӘМС шеңберлерінде сатып алынатын барлық препараттар мен стерильді медициналық бұйымдар тексеріледі.
Бұл қазақстандықтардың қолына препараттардың қандай сапада түсіп жатқанын білу үшін жасалады. Бұл – халықаралық тәжірибе. Негізгі мағынасы мынада: дәрілік препараттардың сапасы оны жеткізу немесе сақтау кезінде дұрыс тасымалданбауы салдарынан емделушінің дәрілік затты пайдалануына дейін-ақ оңай бұзылысқа ұшырауы мүмкін.
Айсұлу Ахимова нарықтан іріктеу кезінде фармацевтикалық өнімнің сәйкессіздігін анықтау жағдайларының байқалғанын өкінішпен атап өтті.
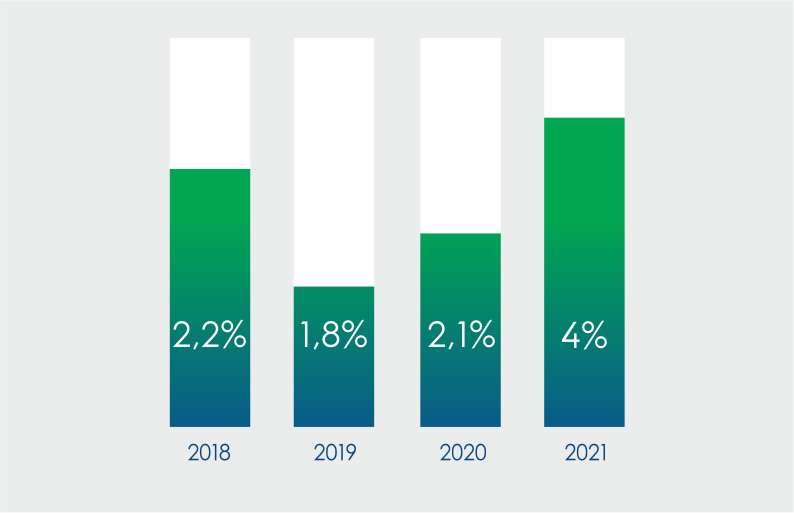
"Жыл сайын анықталатын сәйкессіздіктер құрылымында 80% жуығы дәрілік заттарды таңбалау және қаптау сәйкессіздіктерінің үлесіне тиеді. Бірақ, микробиологиялық тазалық, салмағының ауытқулары және т.б. көрсеткіштер бойынша сәйкессіздіктер санының артуы алаңдатады. Әрине, ондай деректер Медициналық және фармацевтикалық бақылау комитетіне шұғыл жолданады", – деп түсіндірді сарапшы.
Сарапшының түсіндіруінше, егер дәрінің қолданыстағы айналымының қандай да бір сатысында оның сапаға сай келмейтіні анықталса, сапасының бұрмалануы қашан, қай сатыда болғанын және оның немен байланысты екенін анықтау үшін біртұтас әрекет ету жүйесі іске қосылады. Ал, егер сапасына қатысты ақау расталса, ондай өнімді Медициналық және фармацевтикалық бақылау комитеті нарықтан алып тастап, бұрын берілген сәйкестік сертификатының күшін жояды. Сонымен қатар, сертификаттың жарамсыздығы жөніндегі деректер Мемлекеттік тізілімде орналастырылады.
"Соңғы уақытта сәйкестік сертификатын қолдан жасау жағдайлары жиіледі. Бұл құқық қорғау органдары жер-жерде жүргізген тексерулер нәтижелері бойынша да, сондай-ақ медициналық ұйымдардан түскен көптеген шағымдар бойынша да анықталуда", – деп атап өтті Айсұлу Ахимова.
Әрбір тұтынушы сертификат түпнұсқалығын тексеріп, сол арқылы өзін жалған құжаттармен жеткізілетін фармацевтикалық өнімді сатып алудан қорғай алады. Көптеген жағдайларда теріс пиғылды компаниялар сертификаттарды өнімге берілген серия нөмірін түзету арқылы қолдан жасайды.

Сертификатты тексеру үшін оның беткі парағының төменгі сол жақ бөлігінде көрсетілген сілтемені Google немесе Yandex іздеу жүйесіне енгізу керек. Сілтемені енгізуден соң жүйе автоматты түрде серия нөмірін салыстырып тексеру үшін түпнұсқалық құжат бар параққа жолдайды.
Сертификатты QR-кодты сканерлеу арқылы да тексеруге болады. QR-кодты тану үшін оған смартфон камерасын бағыттау жеткілікті. QR-код сізді түпнұсқалық сертификат орналасқан параққа жолдайды.
Бұдан бөлек, Ұлттық орталық берген сәйкестік сертификаттары туралы деректерді www.ndda.kz сайтының Мемлекеттік тізіліміндегі "Сертификаттар" бөлімінен алуға болады. Бөлімге өту үшін Мемлекеттік тізілімде дәрілік препараттың немесе медициналық бұйымның тіркеу куәлігін немесе саудалық атауын әлде өндірушісін теру қажет. Бұдан әрі жүйе өнім туралы барлық ақпаратты, оның ішінде берілген сертификат туралы мәліметтерді ұсынады.
Осылайша, дәрілер мен медициналық бұйымдарды сатып алушы медициналық ұйымдар, дәріханалар мен қатардағы қазақстандықтар өзін жалған дәрі-дәрмектен қорғай алады.
Сондай-ақ, препараттың өзін Dari Kz қосымшасы арқылы да тексеруге болады.
Ал ең бастысы, қосымшада тіркелген препарат: атауы, қаптамасы, қолдану жөніндегі нұсқаулығы және тіпті препаратты бөлшек саудада өткізу кезінде асыруға болмайтын шекті құны туралы барлық ақпарат бар.
Тұтынушы өзін сапасыз препараттарды сатып алудан қалай қорғай алады деген сауалға Айсұлу Ахимова былай жауап берді:
"Дәрілерді препараттың сапасын сақтау үшін тиісті жағдайлары бар лицензияланған дәріханалардан сатып алу керек, өйткені, дұрыс тасымалданбау немесе сақталмау салдарынан тұтынушыға жеткенше сапасын жоғалтуы мүмкін. Сатылымдағы серияның сапасын қамтамасыз ету үшін белгіленген талаптардың қадағаланғанына және заңды жолмен әкелінгеніне көз жеткізу үшін дәріханалық өнімге берілген сәйкестік сертификатын сұрау керек. Сатып алар алдында дәрілік заттың сыртқы түріне назар аудару керек. Қаптамасы тегіс, таза, құрғақ, мәтіні қатесіз болуы тиіс. Қаптамада қазақ және орыс тілдерінде жазылған қолдану жөніндегі нұсқаулық болуы тиіс. Егер сәйкессіздік сертификаты болмаса, жазуының қатесі, ал қаптамасының әдеттегі түсі мен пішінінде өзгешеліктер болса, ол жалған дәрі-дәрмек күмәнін тудыруы мүмкін", – деп түйіндеді сөзін Айсұлу Ахимова.
 USD:
515.7 / 518.3
USD:
515.7 / 518.3
 EUR:
582.0 / 589.0
EUR:
582.0 / 589.0
 RUB:
6.09 / 6.21
RUB:
6.09 / 6.21